厉害了!柴继杰合作再发Nature,至今已发表28篇CNS,详情公布!
时间:2024年03月14日 分类:新闻中心 次数:
2024年3月13日,中国农业大学,西湖大学,清华大学等多单位合作,柴继杰及Paul Schulze-Lefert共同通讯(宋文及刘莉为共同第一作者)在Nature在线发表题为“Substrate-induced condensation activates plant TIR domain proteins”的研究论文,该研究证明了TIR底物NAD+和ATP的结合诱导了体外TIR结构域蛋白的相分离。
在植物中,通过原生启动子表达的TIR结构域蛋白也发生了类似的缩合反应。TIR缩合物的形成是由保守的自缔合界面和预测的TIR的内在无序环区介导的。破坏TIR凝聚体的突变损害了TIR结构域蛋白的细胞死亡活性。该研究揭示了相分离是TIR结构域蛋白激活的一种机制,并为底物诱导的TIR信号自主激活赋予植物免疫提供了见解。
另外,2024年2月15日,清华大学/西湖大学柴继杰及南京农业大学王源超共同通讯在Science 在线发表题为“A plant mechanism of hijacking pathogen virulence factors to trigger innate immunity”的研究论文,本研究表明Phaseolus vulgaris PGIP2 (PvPGIP2)与Fusarium phyllophilum polygalacturonase (FpPG)的相互作用增强了底物结合,从而抑制了FpPG酶的活性。这种相互作用促进了FpPG催化的长链免疫活性低聚半乳糖醛酸酯的产生,同时减少了免疫抑制短链低聚半乳糖醛酸酯。
具有N端Toll/白细胞介素-1受体(TIR)结构域的植物核苷酸结合富亮氨酸重复序列(NLR)免疫受体介导菌株特异性病原体效应物的识别,通常通过其C端配体感应结构域。效应物结合使TIR- NLR (TNL)介导的免疫所需的TIR编码酶活性得以实现。许多截断的TNL蛋白缺乏效应感应结构域,但保留类似的酶和免疫活性。这些TIR结构域蛋白激活的机制尚不清楚。
最后,学术顾问也统计了柴继杰团队合作/署名的发表Science,Nature 及Cell 文章,共计发表28篇,列表如下:
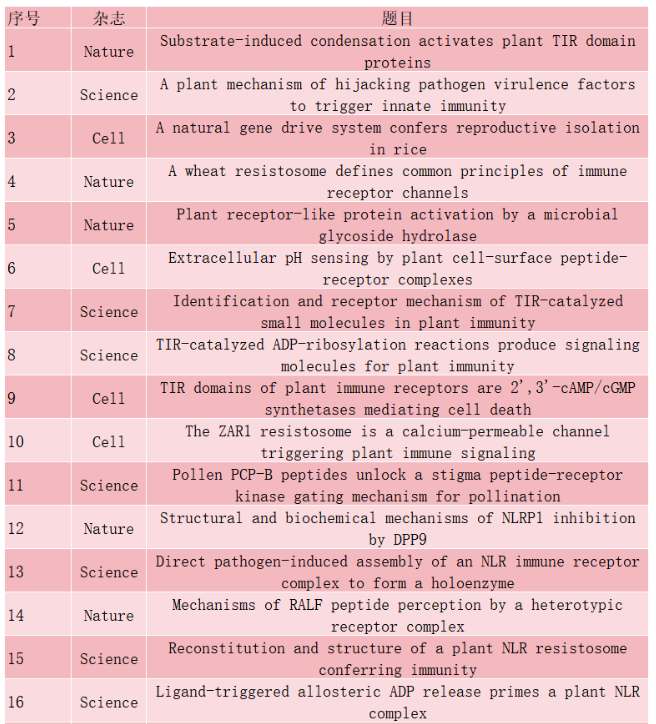

能够在CNS顶刊安排多篇论文,说明团队的科研实力是比较强的,而且对学术界做了很多贡献,CNS期刊发表论文也是有难度的,有意向的人员建议早作准备!
版权声明:文章来源于网络,由本平台整合撰写,版权归原作者或平台所有,分享只为学术交流,如有侵权请联系删除或整改,谢谢。
SCI论文
- 2024-07-20SCI论文投稿四种审稿结果分别对
- 2024-07-2036本药学综述sci期刊清单
- 2024-07-20一投就中|机械工程领域发文首选
SSCI论文
- 2024-07-17一篇sci论文可以保研用吗
- 2024-07-10人类学方向好中的SSCI期刊推荐
- 2024-07-09ssci期刊发表论文没经验要注意什
EI论文
- 2024-07-19数学方面的ei会议怎么找
- 2024-07-19机器人方向EI期刊或EI会议
- 2024-07-19ei论文字数要求
SCOPUS
- 2024-05-29scopus收录哪些管理类期刊
- 2024-05-09管理学发一篇scopus论文难吗
- 2024-04-15SCOPUS检索的会议怎么找
翻译润色
- 2023-05-13神经生物学英文文章如何提升英语
- 2023-05-12sci论文润色的意思
- 2023-05-11生物医学sci论文润色有用吗
期刊知识
- 2024-07-17论文发表C刊能保研吗
- 2024-07-11DOI是什么
- 2024-07-04中外文核心期刊查询系统
发表指导
- 2024-05-16建筑材料工程师晋升职称需要什么
- 2024-05-09北核南核难度加大,想要顺利晋升
- 2024-03-06哪些食品类期刊被ei收录